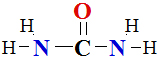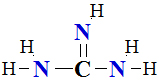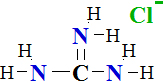I.4
Aminoskābju analīz
Pirmais
solis polipeptīdu analīzē ir hidrolīze
un kvantitatīva aminoskābju satura noteikšana. Atsaucoties amīda saišu
ļoti
lielo pretestību hidrolīzei, polipeptīdu hidrolīzē nepieciešama
karsēšana 6 M
HCl pie 110° C līdz 24-70 stundām vai karsēšana 2 – 4 M NaOH
salīdzināmā
temperatūrā un laika intervālā. Reiz polipeptīds ir hidrolizēts
iegūtais
aminoskābju maisījums tiek analizēts ar jonu apmaiņas hromatogrāfu.
Aminoskābes
tiek detektētas iznākot no kolonas ar ninhidrīnu (Skat kolonu
hromatogrāfija).
Polipeptīdu hidrolīzes un aminoskābju maisījumam noteikšanas jūtība ir
polipeptīda 50 nano moli (50•10—9 mol). Figūra I.5
attēlo polipeptīda hidrolizāta analīzi ar jonu apmaiņas hromatogrāfiju.
Piezīme, ka hidrolīzes laikā sānu-virkņu amīdi asparagīnam un
glutamīnam tiek
hidrolizētas un šīs aminoskābes tiek noteiktas kā glutamīn skābe un
aspargīnskābe.
Katram glutamīna vai asparagīna hidrolizātam rodas ekvivalents amonija
daudzums.
Absorbcija
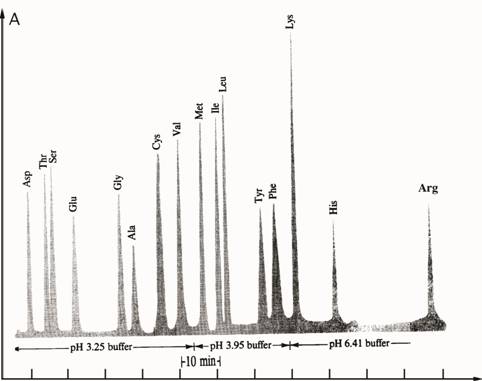
Laiks
Figūra I.5 Aminoskābju
maisījuma analīze ar
jonu-apmaiņas hromatogrāfiju.
I.5 Primārā
struktūra polipeptīdiem un olbaltumvielām
Primārā (1°)
struktūra polipeptīdiem un
olbaltumvielām attiecināma uz aminoskābju secību polipeptīda virknē.
Šinī
sakarībā, primārā struktūra ir pilnīgs apraksts kovalenti saistītai
aminoskābju
secībai polipeptīdā vai olbaltumvielā.
Ir sarežģīti
izvērtēt neticami lielo skaitu dažādiem polipeptīdiem, kuri var tikt
konstruēti
no 20 aminoskābēm, kuros aminoskābju skaits polipeptīdā var sasniegt no
desmit
pāri par simts. Tikai no trīs aminoskābēm, te iznāk 27
dažādi tripeptīdi iespējami. Piemēram, glicīns, alanīns un serīns dod 27
tripeptīdus :
gly—gly—gly
ser—ser—ser ala—ala—ala
gly—gly—ser
ser—ser—gly ala—ala—gly
gly—gly—ala
ser—ser—ala ala—ala—ser
gly—ser—gly
ser—gly—ser ala—gly—ala
gly—ala—gly
ser—ala—ser ala—ser—ala
gly—ser—ala
ser—gly—ala ala—gly—ser
gly—ala—ser
ser—ala—gly ala—ser—gly
gly—ser—ser
ser—gly—gly ala—gly—gly
gly—ala—ala
ser—ala—ala ala—ser—ser
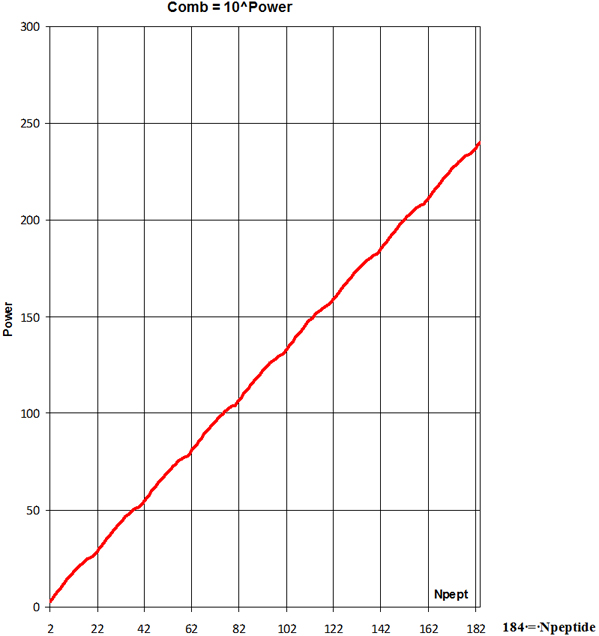
2
Cilvēka
olbaltumvielu statistiskā analīze uzrāda polipeptīdu virkņu vidējo
garumu Npeptide = 184. Tas no
20 = nAA dažādām aminoskābēm
(Kombinācijās-Variācijās) Comb dod
polipeptīdu iespējamo kombināciju
skaitu
pēc formulām
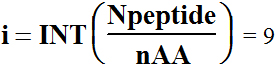 ; m=Npeptide-i*nAA= 4
; m=Npeptide-i*nAA= 4
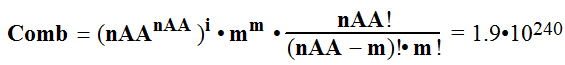
patiesi
neaptverams variāciju-kombināciju skaits no 20 aminoskābēm sakārtoti
polipeptīda virknē sākot no N-termināla un beidzot ar C-terminālu,
kur Power=240 ir kāpinātājs
kombināciju-variāciju skaita Comb
aprēķinā 1,9•10240,
ja Npeptide = 184.
3
I.6
Polipeptīdu un olbaltumvielu struktūra trīsdimensiju
telpā
A. Polipeptīda saites
ģeometrija
1930 gada
beigās, Linus Polings sāka studijas un eksperimentus dziļāk izpētot
trīs-dimensionālo olbaltumvielu struktūru. Viens no pirmajiem
atklājumiem bija,
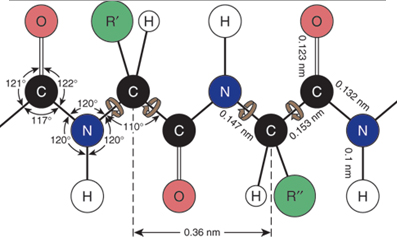
ka peptīdu saite —CO—HN— ir plakana. Kā
parādīts Figūrā I.6,
četri peptīda saites atomi un divi alfa-oglekļi atrodas vienā plaknē —Cα—CO—HN—Cα—.
Vai esat mēģinājuši
agrāk modelēt peptīda saites ģeometriju,
varbūt sekojošā veidā jūs
esat tā domājuši. Tur ir trīs elektronu saišu sablīvējumi ap karbonila
oglekli;
tāpēc paredzamie saišu leņķi ir 120° ap karbonila oglekli. Tur ir četri
elektronu saišu sablīvējumi ap amīda slāpekļa atomu; tāpēc paredzamie
saišu
leņķi ir 109.5° ap šo atomu. Paredzējums pie oglekļa atoma aptuveni
sakrīt ar
leņķi 120°. Tomēr leņķis 120° ap amīda slāpekļa atomu ir negaidīts. Lai
izskaidrotu šo novēroto ģeometriju, Polings uzskatīja, ka nozīmīgi
atbalstāms
ir daudz akurātāk attēlojamas peptīdu saite kā divu hibrīdu rezonanses
struktūras:
I 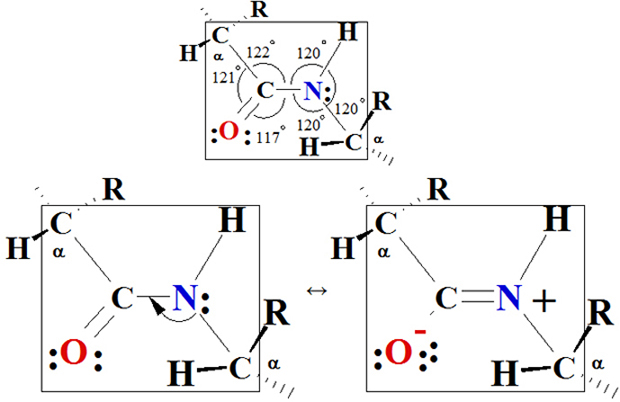 II
II
Figūra I.6 Peptīda saites
plakne. Saišu leņķi ap
karbonil oglekļa un ap amīda slāpekļa atomu ir aptuveni 120°.
Rezonanses
struktūra I
rāda C=O divkāršo
saiti un C—N vienkāršo
saiti. Struktūra II rāda C—O
vienkāršo
saiti un C=N divkāršo
saiti. Ja struktūra I ir galvenais noteicošais hibrīds, tad C—N—C saites
leņķis būtu tuvāks 109.5°. No otras puses ja struktūra II ir galvenais
noteicošais hibrīds, tad C—N—C
saites
leņķis būtu tuvāks 120°. Fakts, ko visupirms novēroja Polings, ir, ka
C—N—C saites
leņķis ir ļoti tuvs 120°, kas nozīmē, ka peptīdu saite ir plakana
(ģeometriskos
terminos planāra) un struktūra II ir galvenais noteicošais rezonanses
hibrīds.
Divas
konfigurācijas ir
iespējamas atomiem peptīda saites plaknē. Vienā konfigurācijā divi a-oglekļi
ir cis
viens pret otru attiecībā pret C—N
saiti,
bet otrajā tie ir trans – katrs savā
pusē C—N saites
plaknē:
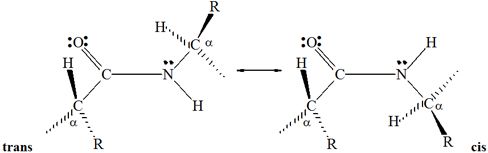
Trans
konfigurācija ir vairāk piemērota, jo vairums a-oglekļa
atomu atrodas tālāk viens no otra, nekā tie ir
cis konfigurācijā. Patiesībā visām
peptīdu saitēm dabas olbaltumvielās ir trans
konfigurācija.
4
B.
Otrējā (sekundārā) struktūra
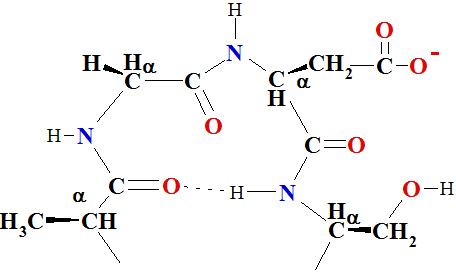
Otrējā (2°) struktūra attiecas uz aminoskābju sakārtotu savienošanos (konformāciju) lokalizētos reģionos polipeptīda vai olbaltumvielas molekulā. Pirmās polipeptīdu konformāciju studijas veica Linus Polings un Roberts Koreis 1939. gada sākumā. Viņi pieņēma, ka konformācijai ir lielāka stabilitāte, ja (1) visi atomi peptīdu saitēs atrodas vienā plaknē, un, ja (2) katrai amīda grupai savstarpēji ir ūdeņraža-saite starp N—H peptīda saitē un C=O citā peptīda saitē, kā parādīts Figūrā I.7. Uz to pamatojas modeļu būvēšana, Polings un Koreis pieņēma, ka divi salocīšanās zīmējumiem jābūt īpaši stabiliem: α-spirāle un antiparalēlās b-plāksnītes. Zīmējums a-spirālei parādīts Figūrā I.7, kā redzams polipeptīdu virkne ir uztīta cilindra veida spirālē.
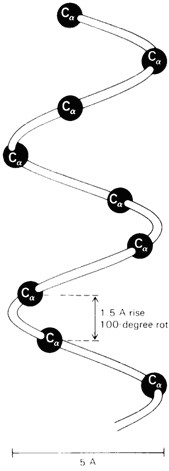
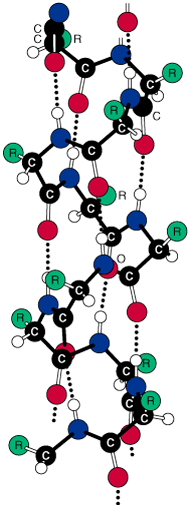
Figūra I.7 (a) Pa labi α-spirāle vanderwālsa rādiusos α-C atomu modelis uz a-spirāles oglekļa-slāpekļa mugurkaula treka. (b) Bumbiņu-un-nūjiņu modelis α-spirālei parāda iekš molekulārās ūdeņraža saites ••• virknē.
Viens pilns tinums α-spirālē satur 3,6 aminoskābes atlikumus un viena pakāpe ir 1,5 Å augsta un 100 º leņķī.
Tā kā Jūs studējiet α-spirāli Figūrā I.7, tad atzīmējam sekojošo:
1. Spirāle ir uztīta pulksteņa rādītāja virzienā vai manierē pa labo roku. Labā-roka nozīmē, ka Jūs uztiniet spirāli pulksteņa rādītāja virzienā, un, ka tas aizliecas prom no Jums. Šinī izpratnē, labās-rokas spirāle ir analoga labās-rokas vītnei koka vai metāla skrūvēm.
2. Ir 3,6 aminoskābes uz vienu spirāles vijumu.
3. Katra peptīda saite ir trans un plakana.
4. Katras peptīda saites N—H
group of each peptide bond points roughly upward, parallel to the axis
of the helix; and the C=O grupas novietojums aptuveni paralēls spirāles ass virzienam uz priekšu; un katras peptīda saites N—H
grupas novietojums arī aptuveni paralēls spirāles ass virzienam, bet pretējā virzienā atpakaļ.
5. Katrai peptīda saites karbonil grupai ir ūdeņraža-saite ar citu peptīda N—H grupu četras aminoskābju struktūrvienības tālāk no tās atrašanās vietas spirālē. Ūdeņraža saite tiek parādīta kā punktēta līnija •••.
6. Visas R— grupas novietotas spirāles ārpusē prom no spirāles.
Gandrīz tūlīt pēc Polinga ierosinātās α-spirāles struktūras, citi pētnieki pārbaudīja α-spirāles klātbūtni keratīnā, vilnas un matu olbaltumvielā. Drīz kļuva redzams, ka α-spirāle ir viena no fundamentāliem otrējās struktūras 2º salocīšanās zīmējumiem polipeptīdu virknēs.
5
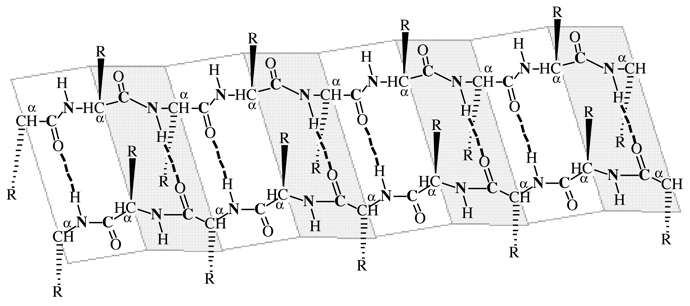
β-plāksnītes sastāv no izklātām blakus esošām polipeptīdu virknēm vērstām pretējos (antiparalēlos) virzienos. Atšķirībā no izkārtojuma α-spirālēs, funkcionālās grupas N—H un C=O atrodas plāksnē un aptuveni perpendikulāri polipeptīdu virkņu asīm plāksnītē. Funkcionālās grupas C=O un H—N no paralēlām kaimiņos esošo virkņu peptīdu saitēm ir saistītas ar ūdeņraža saiti C=O- -
-H—N.
 amino termināls ————> polipeptīda virkne ————> karboksil termināls
amino termināls ————> polipeptīda virkne ————> karboksil termināls 
 karboksil termināls<—————— polipeptīda virkne <—————— amino termināls
karboksil termināls<—————— polipeptīda virkne <—————— amino termināls 
Figūra I.8 β-plāksnīšu konformācija no divām polipeptīdu pretējos (antiparalēlos) virzienos vērstām
virknēm. Ūdeņraža saites starp virknēm ir attēlotas ar pārtrauktu līniju C=O- - -H—N.
Tā kā Jūs studējiet otrējo 2º struktūru β-plāksnītes Figūrā I.8, tad atzīmējam sekojošo:
1. Divas polipeptīdu virknes atrodas blakus viena otrai un stiepjas pretējos (antiparalēlos) virzienos.
2. Katra peptīda saite ir trans un plakana.
3. Polipeptīdi sastāvoši no peptīda saitēm plaknes sekcijām savā starpā saistītas locījumos pa α-oglekļa atomiem.
4. Peptīdu saitēs
C=O
un
N—H
funkcionālās grupas no blakus esošām virknēm vērstas viena pret otru un ir tanī pašā plaknē, tā ūdeņraža saites stiprina otrējo struktūru 2º starp polipeptīdu virknēm.
5. Funkcionālās R— grupas ikkatrā virknē pārmaiņus, plākšņu klājuma virspusē un tad apakšpusē. Plāksnīšu klājuma konformācija ir stabilizēta ar ūdeņraža saitēm no vienas puses starp N—H grupām un no otras puses ar C=Ogrupām no blakus virknes C=O- -
-H—N. Salīdzinoši, a-spirāles stabilizē ūdeņraža saites starp N—H un C=Ogrupām tanī pašā polipeptīdu virknē.
Otrējā ( sekundārā)
2º struktūra apzīmē
a-spirāles,
b-plāksnītes un cita veida periodiskas konformācijas peptīdu vai olbaltumvielu molekulās lokalizētos reģionos tādas kā
beta pagrieziens vai
cilpas tāpat kā
līkumi.
6
Cilpas, loki un līkumi
Lielos vilcienos puse no sastāva "tipiski" globulārām olbaltumvielām sastāda α-spirāles un β-plātnītes, bet otru pusi cilpas, loki, līkumi un citas izvērstas konformāciju iezīmes. Cilpas, loki un līkumi atbilst nelieliem aminoskābju segmentiem, kas saista divas otrējās (sekundārās) struktūras vienības, kā divas blakus šķiedras no antiparalēlām
β-plāksnītēm. β-loks satur četras aminoacil atliekas, kurās pirmā atlieka ir saistīta pie ceturtās ar ūdeņraža-saiti, rezultējoties 180-grādu pagriezienā (Figūra 5–7). Prolīnu un glicīnu visbiežāk satur β-loki vai β-cilpas.
Termins otrējā (sekundārā 2°) struktūra tiek lietota aprakstot α-spirāles, β-plātnītes un β-cilpas - periodiskas konformācijas lokalizētos polipeptīdu vai olbaltumvielu molekulu reģionos.
C. Trešējā (terciārā 3°) struktūra
Trešējā (terciārā 3°) struktūra attiecas uz kopējo salocīšanās zīmējumu un izkārtojumu telpā visiem vienas polipeptīdu virknes atomiem. Patiesībā nepastāv skaidri nodalošas līnijas starp otrējo un trešējo struktūru. Trešējā struktūra attiecas uz telpiski ciešu vienam pret otru aminoskābju izkārtojumu polipeptīda virknē un trešējā struktūrā attiecas uz trīs-dimensionālu izkārtojumu visiem atomiem polipeptīda virknē.
Disulfīda saites (Sskat.nodaļu par tioliem) ir nozīmīgas trešējās struktūras uzturēšanai.
Disulfīda saites veidojas starp cisteīniem blakus virknēs divu tiola grupu (
Cys—SH)
oksidēšanā veidojot
disulfīda saiti (
Cys—S—S—Cys), kā parādīts cisteīna saturošo polipeptīdu daļās:
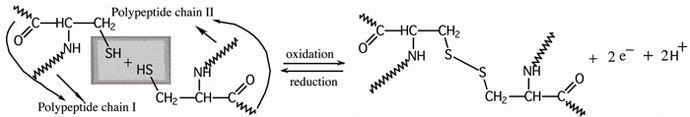
cisteīna struktūrvienības blakus esošās polipeptīdu virknēs disulfīda saite (tiltiņš) starp cisteīna tiola grupām
Apstrādājot disulfīda saites ar reducētāju reģenerē tiola grupas to reducējot.
 7
7
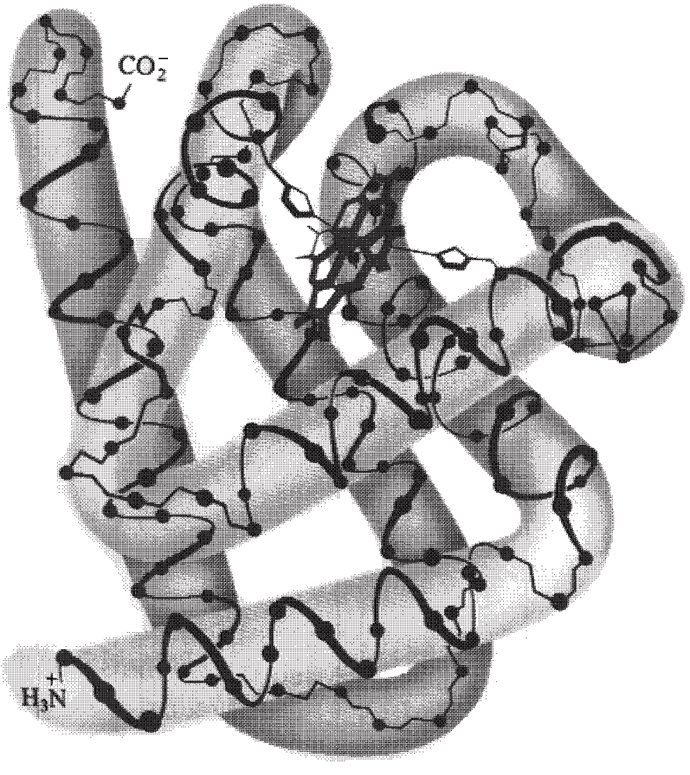 Četras svarīgākās strukturālas iezīmes mioglobīnā ir:
Četras svarīgākās strukturālas iezīmes mioglobīnā ir:
1. Mugurkauls sastāv no astoņām 8 relatīvi taisnām sekcijām a-spirālēm A, B, C, D, E, F, G, H, katra atdalīta ar
β-cilpu polipeptīda virknē. Garākajā α-spirāles sekcijā ir 23 aminoskābes, īsākajā ir 7. Kādi 75% no aminoskābēm atrodamas šajos astoņos α-spirāļu reģionos.
2. Hidrofobās sānu virknes, kā fenilalanīns, alanīns, valīns, leicīns, izoleicīns un metionīns ir sakopoti molekulas iekšpusē, kurā skābeklis O=O tiek norobežota no kontakta ar ūdeni un ūdeņraža hidroksonija joniem  . Hidrofobā mijiedarbība starp nepolārajām sānzaru virknēm ir nozīmīgs virzītājs mioglobīna polipeptīda virknes salocīšanā kompaktā, trīs-dimensionālā formā.
. Hidrofobā mijiedarbība starp nepolārajām sānzaru virknēm ir nozīmīgs virzītājs mioglobīna polipeptīda virknes salocīšanā kompaktā, trīs-dimensionālā formā.
3. Mioglobīna virsma ir noklāta ar hidrofīlām sānu zaru virknēm, tādām kā lizīns, arginīns, serīns, histidīns, glutamīnskābe un glutamīns, kuras mijiedarbojas ar ūdens vidi radot ūdenī šķīstošu hidrāta apvalku. Vienīgās polārās sānu virknes ir atzīmējamas mioglobīna molekulā divi histidīni. Šīs sānu virknes var redzēt Figūrā I.9 kā piecu-locekļu cikli novietoti virzienā uz hēma grupu mioglobīna molekulas iekšpusē.
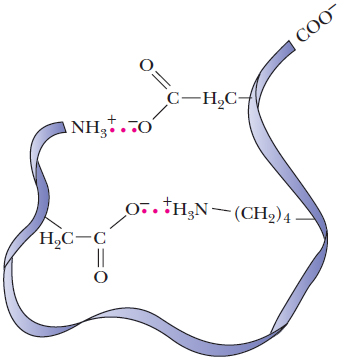
4. Pretēji lādētās aminoskābes cieši viena pie otras trīs-dimensionālā struktūrā mijiedarbojas ar elektrostatiskajiem pievilkšanās spēkiem saukti par
sāls slēdzenēm vai
sāls tiltiņiem. Piemēram,
sāls tiltiņš izveido pievilkšanos sānu virknēs starp lizīna amino

un glutamīnskābes karboksil

grupām.
Trešējā struktūra atsevišķām citām
globulārām olbaltumvielām arī ir konstatēti. Ir skaidrs, ka
globulārās olbaltumvielas satur
α-spirāles un
β-plāksnīšu struktūras un arī, ka relatīvais katra daudzums variē plašās robežās.
Lizozīmam ar 129 aminoskābēm vienā polipeptīda virknē ir tikai 25% no tā aminoskābēm
a-spirāļu reģionos.
Citohromam ar 104 aminoskābēm vienā polipeptīda virknē nav
α-spirāļu struktūru, bet satur dažus reģionus no
β-pāksnītēm. Lai gan proporcija atšķiras
α-spirālēm,
β-pleated sheet. Yet, whatever the
proportions of
α-spirālēm,
β-plāksnītēm vai citām periodiskām struktūrām, patiesībā visas nepolārās sānu virknes
globulārajās olbaltumvielās ir vērstas uz iekšpusi molekulā, kamēr polārās sānu virknes ir uz molekulas ārējās virsmas un ir kontaktā ar ūdens vidi. Tā kā līdzīga veida
hidrofobā/hidrofīlā mijiedarbība, kura ir atbildīga par ziepju
micellu (Skat. Virsmas aktīvas vielas) un fosfolipīdu
dubultslāņa formēšanos (Skat. Membrānu uzbūve), ir noteicoša par
globulāro olbaltumvielu
trīs-dimensionālo veidu.
Piemērs I.5 Ar kuru no sekojošo aminoskābju sānu virknēm var ar treonīna sānu virkni veidot
ūdeņraža saites?
a. valīnu
b. asparagīnu
c. fenilalanīnu
d. histidīnu
e. tirozīnu
f. alanīnu
Risinājums Sānu virkne treonīnā satur hidroksil grupu —
OH, kas var veidot
ūdeņraža saiti divos veidos: skābeklim ir daļēji negatīvs lādiņš un var funkcionēt kā ūdeņraža saites akceptors; ūdeņradim ir daļēji pozitīvs lādiņš un var funkcionēt kā ūdeņraža saites donors. Tāpēc sānu virkne treonīnā var funkcionēt kā ūdeņraža saites akceptors tirozīna, asparagīna un histidīna sānu virknei. Treonīna sānu virkne var funkcionēt arī kā ūdeņraža saites donors tirozīna, asparagīna un histidīna sānu virknei.
Problēma I.5 Pie pH=7.4 kādai aminoskābei sānu virknē var veidoties sāls tiltiņš ar lizīna sānu virkni?
8
D. Ceturtējā 4º struktūra
Vairākums olbaltumvielas ar molmasu lielāku nekā 50 000 sastāv no divām vai vairāk ar pieciem 5 starp molekulārajiem spēkiem saistītām polipeptīdu virknēm. Olbaltumvielu monomēru sakārtojums agregātos ir zināms kā ceturtējā (4°) struktūra. Labi izpētīts piemērs ir hemoglobīns, olbaltumviela sastāvoša no četriem atsevišķiem olbaltumvielu monomēriem: divas α-virknes ar 141 aminoskābi katra un divas β-virknes ar 146 aminoskābēm katra. Ceturtējā (4°) struktūra hemoglobīnam ir parādīta Figūrā I.11.
beta virkne
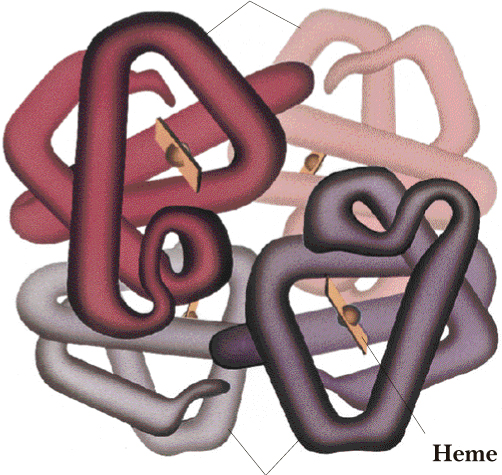
alfa virkne
Figūra I.11 Ceturtējā (4°) struktūra hemoglobīnā, parāda četras subvienības sapakotas kopā. Plakanie diski pārstāv četras hēma vienības.
Vadošais faktors stabilizējošs olbaltumvielu subvienību salipšanu ir hidrofobā mijiedarbība. Ja nošķirtie monomēri salokās kompaktā trīs-dimensionālā formā vēršot polārās sānu virknes uz ūdens vidi un aizsedz nepolārās sānu virknes no ūdens, tur uz virsmas vēl ir hidrofobi "plankumi" kontaktā ar ūdeni. Šie plankumi var būt aizsegti no ūdens ja divi vai vairāki monomēri salīp, ka to hidrofobie plankumi ir kontaktā. Molmasas skaitlis subvienībai un bioloģiskās funkcijas atsevišķām olbaltumvielām ar ceturtējo (4°) struktūru ir parādītas Tabulā I.7.
Tabula I.7
Ceturtējā |
Olbaltumvielas
|
Mol.Masa
|
Subvienību
skaits |
Sub.Mol.
Masa |
Bioloģiskās funkcijas
|
struktūra
dotajām
olbaltum-vielām. |
insulīns
hemoglobīns
alkohola dehidrogenāze
laktāta dehidrogenāze
aldoāze
fumarāze
tabakas
mozaikas vīruss
|
11 466
64 500
80 000
134 000
150 000
194 000
40 000 000
|
2
4
4
4
4
4
2280
|
5 733
16 100
20 000
33 500
37 500
48 500
17 500
|
hormons regulā
glikozes metabolismu
skābekļa transports asins plazmā
enzīms etanola
oksidēšanai
enzīms aneirobā glikolīzē
enzīms aneirobā glikolīzē
enzīms trikarboksilāta Krebsa
ciklā
augu vīrusa apvalka olbaltums
|
9
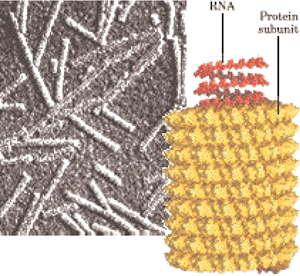

Figūra I.12a Tabakas mozaikas vīrusa ceturtējā struktūra uzbūvēta no 2200 olbaltumvielas subvienībām un
kurā ietinusies informatīvā RNS virkne, daļēji ietīta olbaltumvielas ceturtējā spirāles simetrijas struktūrā līdzīgi caurules cilindram 3000  garumā un 180
garumā un 180  āfrējais diametra izmērs.
āfrējais diametra izmērs.
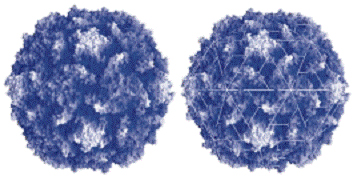
Figūra I.12b Polio vīrusa apvalks-capsīdu ceturtējā struktūra aplīmēta ar olbaltumvielu subvienībām ikosaedra rotējošā simetrijā ar 300  izmēru un kura ietin ribonucleīnskābes RNS informatīvo virkni,
izmēru un kura ietin ribonucleīnskābes RNS informatīvo virkni,
daļēji ietīta olbaltumvielu ceturtējā struktūrā.
10
E. 1° Struktūra nosaka 2°, 3° un 4° struktūru
Pirmējo olbaltumvielu struktūru nosaka gēnu informatīvais kods. Reiz olbaltumvielas pirmējā struktūra ir izveidojusies, šī izkārtojuma struktūra nosaka polipeptīda virknes salocīšanos trīs-dimensionālā struktūrā. Citiem wārdiem sakot, iedzimtības informācija olbaltumvielas pirmējā struktūrā nosaka tās otrējo, trešējo un ceturtējo struktūru.
Ja trīs-dimensionālais veids polipeptīdam vai olbaltumvielai ir determinēts ar tās pirmējo struktūru, kā mēs varam izskaidrot novērokumus, ka denaturācija ir neatgriezeniska dažādām olbaltumvielām un ne otrādi?
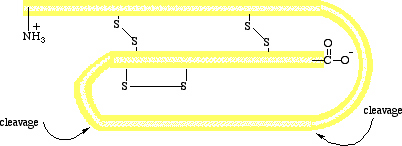
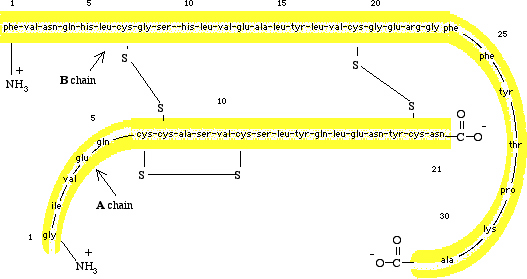
Figūra I.13 (augšā) Pro-insulīna shematiska diagramma, viena polipeptīda virkne no 84 aminoskābēm.
(apakšā) Aminoskābju secība vērša insulīnā.
Iemesli dažādai olbaltumvielu uzvedībai no vienas olbaltumvielas uz citu ir, ka dažas olbaltumvielas, kā ribonukleāze, tiek sintezētas kā atsevišķa polipeptīdu virkne, kura tad salokas unikālā trīs-dimensionālā struktūrā ar pilnvērtīgu bioloģisko aktivitāti. Citas, līdzīgas insulīnam, atiek sintezētas kā garākas molekulas, kuras nav bioloģiski aktīvas no sākuma, bet "aktivējas" vēlāk ar specifisku enzīmu-katalizēta peptīda-saišu hidrolīzē. Insulīnstiek sintezēts aizkuņģa dziedzera beta šūnās kā viena polipeptīda virkne no 84 aminoskābēm. Šai molekulai, saukta par pro insulīnu, nav bioloģiskās aktivitātes. Kad insuīns ir neepieciešams, segments ar 33 aminoskābēm tiek hidrolizēts no pro insulīna enzīma-katalizētā reakcijā izveidojot aktīvu hormonu (Figūra I.13). Vēršae insulīns satur 51 aminoskābi divās polipeptīdu virknēs. A virkne satur 21 aminoskābi ar glicīnu (Gly[G])  terminālā un aspargīnu (Asn[N])
terminālā un aspargīnu (Asn[N]) terminālā. B virkne satur 30 aminoskābes ar phenilalanīnu (Phe[F])
terminālā. B virkne satur 30 aminoskābes ar phenilalanīnu (Phe[F])  terminālā un alanīnu (Ala[A])
terminālā un alanīnu (Ala[A])  terminālā..
terminālā..
11
Tā kā vadošā informācija oriģinālai formai atsevišķai polipeptīda pro insulīna virknei ir klāt neesoša A un B virknēs aktīvajā hormonā, denaturēta olbaltuma atpakaļ salocīšanās jeb redenaturācija ir nekorekta un denaturācija kļūst par neatgriezenisku.
Zimogēni ir enzīmi producēti kā neaktīvas olbaltumvielas, kuras tiek aktivētas ar vienas vai vairāku polipeptīdu saišu hidrolīzi. Krājumu producēšana naktīvu olbaltumvielu formā dabā ir parasta. Piemēram, gremošanas enzīmi tripsīns un himotripsīns tiek producēti aizkuņģa dziedzerī kā neaktīvas olbaltumvielas, nosauktas par tripsinogēnu un himotripsinogēnu. Tam ir loģisks un vienkāršs iemesls par zimogēnu sintēzi. Tripsīna un himotripsīna gadījumā, to funkcija ir katalizēt zarnu traktā ar uzturu uzņemto olbaltumvielu hidrolīzi. Olbaltumvielas tiek hidrolizētas līdz sastāvdaļām aminoskābēm un tad absorbētas cauri zarnu sieniņām asins plazmā. Ja trypsīns un himotripsīns būtu producēti kā aktīvi enzīmi, tad varētu katalizēt to pašu hidrolīzi kā parasti kādu no ctām olbaltumvielām aizkuņģa dziedzera ietekmē, "paša-noārdīšanas" sistēma. Daba ir aizsargājusies pret šādām iespējamībām ar sintēzi un uzkrājot zimogēnus.
F. Denaturācija
Globulārās olbaltumvielas dzīvajos organismos ir ievērojami jūtīgas pret vides izmaiņām (pH, T, VAV, šķīdinātāja sastāvs, mehāniska iedarbība, karbamīds). Relatīvi nelielas izmaiņas pH, temperatūra, mehāniska iedarbība un šķīdinātāja sastāvs, pat tikai īsu laika sprīdi, var izraisīt denaturāciju. Denaturāciju veic mehāniskas-fiziskas aktivitātes. Izņemot disulfīda un koordinatīvo saišu saraušanu, denaturācijas būtība izmaiņām ir otrējās, trešējās vai ceturtējās struktūras sagraušana noārdot nekovalentās starp molekulārās mijiedarbības spēkus, tādus kā ūdeņraža saites, sāls tiltiņi un hidrofobās saites. Ir atzīmējami sekojoši denaturējošie aģenti:
1. Karsēšana. Vairums globulāro olbaltumvielu denaturējas kad karsē virs T > 50-60° C. Piemēram, vārot vai cepot olas baltuma un dzeltenuma olbaltumvielas denaturējas, veidojot nešķīstošu masu.
2. Lielas pH izmaiņas. Koncentrētas skābes vai sārma pievienošana olbaltumvielām ūdens šķīdumos izraisa izmaiņas lādiņa vērtības jonizējamās sānu virknēs un iejaucas sāls tiltiņos. Piemēram, noteiktos klīniskās ķīmijas testos, kuros nepieciešams vispirms attīrīt no olbaltuma materiāla, trihloretiķskābe (stipra organiska skābe) tiek pievienota denaturējot un izgulsnējot katru klātesošo olbaltumvielu.
3. Detergenti (VAV). Apstrādājot olbaltumvielas ar virsmas aktīvām vielām (VAV) tādām kā nātrija dodecilsulfātu (sodium dodecylsulfate SDS), (skat. virsmas aktīvas vielas), detergents, izraisa naturālās konformācijas atlocīšanos un atsedz nepolārās olbaltumvielas sānu virknes eksponējot pret ūdens vidi. Šīs sānu virknes tad stabilizē hidrofobās mijiedarbības saites ar detergenta (VAV) molekulas ogļūdeņražu virknēm.
4. Organiskie šķīdinātāji tādi kā etanols, acetons vai citi.
5. Mehāniska iedarbība. Vairums globulāro olbaltumvielu tiek denaturētas ūdens šķīdumos ja tos enerģiski maisa vai krata. Piemēram, uzputojot olas baltumu, pagatavojot bezē cepumus vai peldošās salas pudiņu.
6. Karbamīds (urīnviela) un guanidīna hidrohlorīds izraisa olbaltumvielas
ūdeņraža saišu un
hidrofobo saišu saraušanu. Tāpēc, ka
urīnviela ir maza molekula ar augstu polaritātes pakāpi, tā ir labi šķīstoša ūdenī.
Urīnvielas 8M (480 g/L) ūdens šķīdums tiek parasti lietots olbaltumvielu
denaturācijai.
Guanidīns tiek iegūts no
urīnvielas, kurā
>C=O tiek aizvietots ar
=NH.
Guanidīns ir stipra bāze un reaģē ar
HCl veidojot sāli
guanidīna hidrohlorīds.
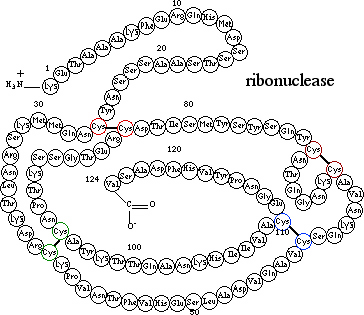
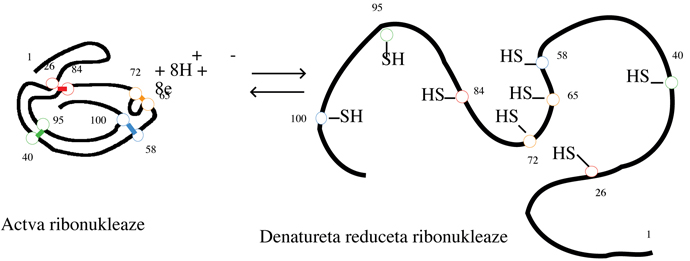
Denaturācija var būt daļēja vai pilnīga. Tā var būt arī atgriezeniska vai neatgriezeniska. Piemēram, hormons insulīns var tikt denaturēts ar 8M urīnvielu šķīdumā un tad trīs disulfīda saites Cys—S—S—Cys reducējas par sešām brīvām Cys—SHgrupām. Ja urīnviela tiek aizvākta un disulfīda saites atjaunotas ar oksidēšanu, rezultējošām molekulām ir mazāk kā 1% no iepriekšējās bioloģiskās aktivitātes. Šinī gadījumā denaturācija ir abējādi pilnīga un neatgriezeniska. Domājot par citu piemēru, ribonukleāze ir enzīms, kas sastāv no vienas polipeptīdu virknes kompakti salocītam 124 aminoskābēm, trīs-dimensionālā struktūra daļēji stabilizēta ar četrām disulfīda saitēm
Cys—S—S—Cys.
Ribonukleāzi apstrādājot ar urīnvielu notiek molekulas atlocīšanās, jo disulfīda saite
Cys—S—S—Cys tiek reducēta par tiola grupu Cys—SH.
Olbaltumviela ir pilnīgi denaturēta, tas ir tai nav bioloģiskās aktivitātes. Ja urīnviela tiek aizvākta no šķīduma un tiola grupas Cys—SH
reoksidētas par disulfīda saitēm
Cys—S—S—Cys,
olbaltumviela atgūst tās pilno bioloģisko aktivitāti. Šinī gadījumā, denaturācija ir bijusi pilnīga bet atgriezeniska.
12
I.7 Fibrilārās olbaltumviela
Fibrilāras olbaltumvielas ir stiegrotas, fiziski cieši sakopotas makromolekulas polipeptīdu virknes līdzīgas rīkstēm sasaistītas kopā ar atsevišķu tipu šķērs-savienojumiem veidojot stabilu nešķīstošu struktūru. Divas fibrilāro olbaltumvielu galvenās klases ir keratīns ādā, wilnā, nagos, ragos kā arī spalvās un kollagens cīpslās kā arī kažokos.
A. Alfa-keratīns
Mati un vilna ir ļoti lokani un arī elastīgi, tā kā slodzei atslābinoties, fibrila atgeiežas oriģinālā garumā. Fundamentāla strukturāla matu vienība molekulāra līmenī ir savijusies olbaltumviela α-spirāles konformācijā (Figūra I.14). Strukturāla organizācija dažādos līmeņos ir uzbūvēti no vienkāršām α-spirālēm. Pirmie trīs α-spirāļu pavedieni griežās kopā veidojot garu virvi sauktu par protofibrilu. Protofibrili ir tad savijušies sainī veidojot 11-pavedienu tauvu sauktu mikro fibrila. Šie gājieni tiek ieguldīti garākā matricā, kas visbeidzot veido matu šķiedru-fibrilu (Figūra I.14). Kad mati ir izstiepti ūdeņraža saites pagarina katra α-spirāles gājienu garenvirzienā. Galvenie radītie spēki ar matu šķiedru izstiepšanu atjauno to oriģinālo garumu ar α-apirāles ūdeņraža saišu re-formēšanos.
α-keratīniem ragos un nagos ir tāda pati struktūra kā matiem bet ar daudz lielāku cisteīna (Cys) koncentrāciju un lielāku disulfida šķērssaišu Cys—S—S—Cyspakāpe starp atsevišķām spirālēm. Šīs papildus disulfīdu saitesCys—S—S—Cys
stipri palielina pretestību stiepei un producē cietu keratīnu ragiem un nagiem.13
B. Kolagēna trīskāršā spirāle
Kolagens ir sastāvdaļa ādai, kauliem, zobiem, asins vadiem, cīpslām, skrimšļiem un saistaudiem. Tā ir lielākā olbaltumvielu daļa augstākajos mugurkauliniekoss un aizpilda gandrīz 30% no cilvēka ķermeņa kopējās masas. Tabula I.8 uzskaita kollagena saturu atsevišķos audos. Piezīme ka kauls, Ahilesa cīpsla, āda, un acu radzene ir lielā mērā kollagens.
Tabula I.8
Kolagena saturs |
audi
|
Kolagens
(% sauss svara) |
audi
|
Kolagens
(% sauss svara) |
dažādos ķermeņa
audos |
kauli, brīva no
Ahilesa cīpsla
āda ,
acu radzene |
88
minerāliem 86
72
68 |
skrimšļi
saites
aorta |
46-63
17
12-24 |
Tā kā kolagēns ir lielākais un izplatītākais mugukauliniekos un tā kā tas ir saistīts ar daudzveidīgām slimībām un novecošanas problēmām, vairāk ir zināms par šīm fibrilārām olbaltumvielām nekā par kādām citām. Kolagēna molekulas ir ļoti lielas un ir kompozīcija no izcilām aminoskābēm. Viena-trešā daļa no visām aminoskābēm kolagēnā ir glicīni un citi 21% ir vai nu hidroksilizīns vai hidroksiprolīns (skat. aminoskābes). Abas hidroksilētās aminoskābes tiek veidotas pēc to vecāku aminoskābju (L-prolīna un L-lizīna) un kolagēna molekulā iebūvētas. Tā kā cisteīns ir gandrīz pilnīgi klāt neesošs, tur kolagēnā nav disulfīda šķērs-saites. Kad kolagēna šķiedras tiek vārītas ūdenī, tās tiek pārvērstas nešķīstošā želatīnā.
Kolagēna polipeptīda virkne daļēji salokās stabilā un unikālā konformācijā. Šinī konformācijā, trīs olbaltumvielu pavedieni aptinās viens ap otru veidojot kreiso super spirāli sauktu par kolagēna trīskāršo spirāli. Šīs veidojums, saukts par tropokolagēnu, izskatās loti līdzīgs trīs-pavedienu rīkstei (Figūra I.15).
Hidroksil grupas hidroksiprolīna un hidroksilizīna atlikumiem palīdz uzturēt trīskāršo spirāles struktūru veidojot ūdeņraža saites >C=O•••H—N<< starp blakus virknēm. Šķiedras, kurās prolīna un lizīna grupas nav hidroksilētas ir daudz nestabllākas, nekā šķiedras, kurās šīs grupas ir hidroksilētas. Viena no svarīgākajām vitamīna C funkcijām ir hidroksilēt kolagēnu. Bez adekvāta vitamīna C uzņemšanas, kolagēna metabolisms tiek izbojāts, izraisot skorbutu-cingu, apstākļi, kuros tropokolagēna šķiedras veidojas nestabīlas fiziski neizturīgas šķiedras. Skorbuts-cinga rada ādas lobīšanos, trauslus asins vadus un asiņojošas smaganas.
Kolagēna šķiedras veidojas kad daudzas tropokolagēna molekulas līdzinās vien blakus pie otras regulārā rakstā un tiek tad šķērssaistītas ar jaunveidotām kovalentām šķērssaitēm. Visvairāk kovalentā šķērsaistīšanā iesaistās lizīna sānu virknes. Šķērssaistīšanās apjoms un tips variējas no vecuma un fizioloģiskajiem apstākļiem. Piemēram, kolagēns žurkas Ahilesa cīpslās ir stipri šķērssaistītas un kolagēns vairāk lokans žurkas astes cīpslās ir mazāk šķērssaistīts. Turpmāk nav īsti skaidrs kad gan šķērssaistīšanās process tiek pabeigts pilnīgi. Visticamāk tas turpinās visu dzīves laiku, veidojot pastiprināti stīvāku ādu, asins vadus un citus audus, kurus tad attiecina uz medicīniskām problēmām novecojot un vecumā, apzīmējot to ar kaulu un audu trausluma pieaugumu.
I.8 Plazmas olbaltumvielas: globulāro olbaltumvielu piemēri
Cilvēka asinis sastāv no šķidrās ūdens šķīduma daļas (plazmas) un šūnu komponentes. Šūnu komponente, kura sastāda 40-50% no kopīgā asiņu tilpuma, sastāv no sarkanajām asins ķermenīši (eritrocītiem), baltajiem asins ķermenīšiem (leikocītiem) un asins plātnītes (trombocīti). Cilvēka plazma sastāv visvairāk no ūdens
(90-92%) kurā ir izšķīdinātas neorganiski joni un heterogēns organisku molekulu maisījums, lielākā grupa, no kurām tiek plazmas olbaltumvielām. Senākā plazmas olbaltumvielu sadalīšanas metodē frakcijās lietoja amonija sulfāta "izsālīšanu" dažāda tipa olbaltumvielās. Frakcija izgulsnēta no plazmas 50% piesātinātā amonija sulfātā tiek saukta globulīns. Ar šo sāls koncentrāciju neizgulsnētā frakcija tiek izgulsnēta no plazmas ar piesātināta amonija sulfātu un sauc par albumīnu. Elektroforēze ir visvairāk lietotā metode mūsdienās, lai sadalītu olbaltumvielas no bioloģiskiem šķidrumiem frakcijās, īpaši klīniskajās laboratorijās, kurās to lieto pamatā cilvēka plazmas olbaltumvielu, urīna un muguras smadzeņu šķidrumiem. Ir izvērtēts, ka starp 15 un 20 miljoniem plazmas-olbaltumvielu elektroforēzes analīzēm tiek veiktas katru gadu Savienotajās Valstīs (ASV) un Kanādā.
Plazmas-olbaltumvielu elektroforēze: plazmas paraugs tiek uzlikts kā tieva līnija celulozes acetāta strēmeles. Strēmeles gali tiek iemērkti bufera šķīdumā pH 8.8 un pieslēgts spriegums strēmeles galiem. Pie
pH 8.8 plazmas olbaltumvielām ir negatīvs lādiņš tās migrē pozitīvā elektroda virzienā. Pēc noteikta laika, celulozes acetāta strēmele tiek izņemta, žāvēta un apsmidzināta ar olbaltumvielas selektīvi krāsojošu vielu. Sadalītās olbaltumvielu frakcijas tad parādās uz attīstītās strēmeles kā plankumi (Figūra I.16 (a) ). Olbaltumvielu daudzumu katrā plankumā tiek noteikts ar densitometru mērot katra plankuma pīķa intensitāti.
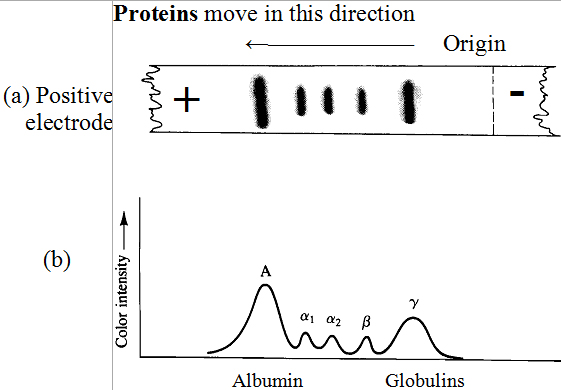
Elektroforēze uz celulozes acetāta sadala seruma olbaltumvielas piecās lielās frakcijās: viena albumīna frakcija un četrās globulīna frakcijās. Četras globulīna frakcijas tiek novērtēti apzīmētas α1, α2, β un γ atbilstoši to elektrofrētiskajam kustīgumam. Seruma albumīnam izoelektriskais punkts ir pie pH 4.9 un migrē vistālāk pozitīvā elektroda virzienā. Gamma-globulīnam izoelektriskais punkts ir pie pH 7.36 un migrē visīsāko distanci. Tabulā I.9 ir parādītas koncentrācijas piecām lielākajām olbaltumvielu frakcijām cilvēka serumā.
Primārā funkcija albumīnam ir regulēt osmotisko spiedienu asinīs. Papildus albumīni ir svarīgi taukskābēm un noteiktiem medikamentiem kā aspirīnam un citiem. Frakcija α1 un α2 transportē citas biomolekulas, tādas kā tauki, steroīdi un fosfolipīdi un dažādi citi lipīdi.
Tabula I.9
koncentrācijas |
Frakcija |
(g/100 mL)
|
No kopējā
Proteīni % |
svarīgākās
cilvēka seruma
olbaltumvielas
noteiktas ar
elektroforēzi. |
albumīns
globulīni
α1
α2
β
γ |
3.5-5.0
0.1-0.4
0.5-1.1
0.6-1.2
0.5-1.5 |
52-67
2.5-4.5
6.6-13.6
9.1-14.7
9.0-21.6 |
Frakcija α1 satur arī antitripsīnu, olbaltumvielu, kas inhibē olbaltumvielu-gremošanas enzīmu tripsīnu. Frakcija α2 satur haptoglobulīnu, kurš saista katru hemoglobīnu atlaistu no saplēstas sarkanās asins šūnas un ceruloplasmīns, galvenā ķermeņa varu-saturoša olbaltumviela. Frakcija α2 arī satur protrombīnu, neaktīva forma asins-sarecēšanas enzīms trombīns. Frakcija βsatur dažādas specifiskas transporta olbaltumvielas, kā tādas vielas iesaistītas asins sarecēšanā.
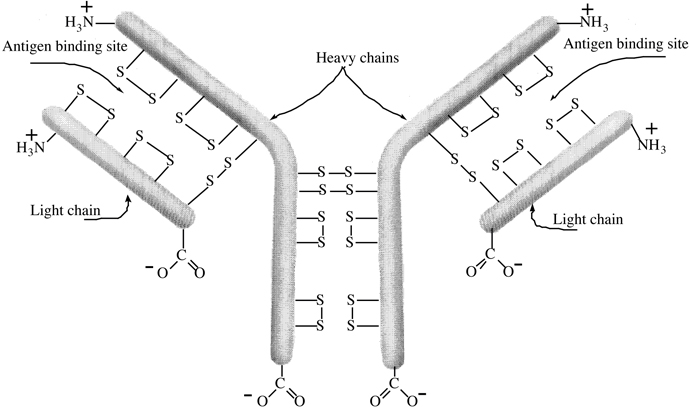
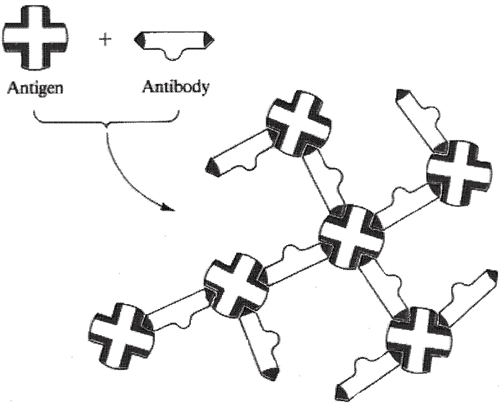
Frakcija γ-globulīns sastāv primāri no antivielām (imunoglobulīniem), kuru funkcija ir cīnīties ar antigēniem (svešām vai nevēlamām olbaltumvielām organismā) iekļuvušām saimnieka ķermenī. Specifiskās antivielas tiek veidotas imūnā sistēmā atbildot uz specifiskiem antigēniem. Atbilde ir pamats imunizācijai pret šādām infekcijas slimībām kā polio, tetanus un difterija. Antiviela sastāv no divu smago (lielas-molmasas) un divu vieglo (mazas-molmasas) polipeptīdu virkņu kombinācijas saistītas kopā ar četrām disulfīda saitēm Cys—S—S—Cys (Figūra I.17). Katrai antivielai ir divas identiskas saistīšanas vietas paratopi, kuri reaģē ar specifisku antigēnu veidojot nešķīstošu kompleksu sauktu par precipitīnu. Precipitīna veidošana deaktivē antigēnu un atļauj to aizvākt un sadalīt baltajām asins šūnām (leikocītiem-makrofāgiem).
Precipitīna kompleks (nešķīstošs)
Figūra I.17 Trīs-dimensionāla veida antivielas projekcija. Mijiedarbība starp antivielu un tās specifisko antigēnu veido neaktīvu precipitīna kompleksu. Izgulsnētais antigēna-antivielas kompleks tiek tad sagremots un noārdīts baltajās asins šūnās.
![]() grupu
un sakārtoti pa labi sākot no
grupu
un sakārtoti pa labi sākot no ![]() grupas,
kura tiek saukta par N-terminālo aminoskābi, līdz
brīvai
grupas,
kura tiek saukta par N-terminālo aminoskābi, līdz
brīvai ![]() grupai, kuru sauc par C-terminālo aminoskābi.
Strukturālā formula polipeptīda virknei ir
uzrakstāma pilniem nosaukumiem vai aminoskābju secībā lietoti standarta
trīs
burtu vai viena burta saīsinājumā ekonomējot kopējo garumu polipeptīda
nosaukumam.
grupai, kuru sauc par C-terminālo aminoskābi.
Strukturālā formula polipeptīda virknei ir
uzrakstāma pilniem nosaukumiem vai aminoskābju secībā lietoti standarta
trīs
burtu vai viena burta saīsinājumā ekonomējot kopējo garumu polipeptīda
nosaukumam. 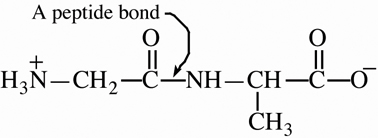

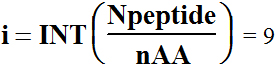 ; m=Npeptide-i*nAA= 4
; m=Npeptide-i*nAA= 4 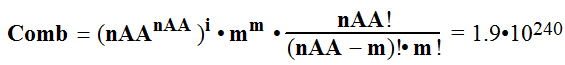

 II
II







 7
7 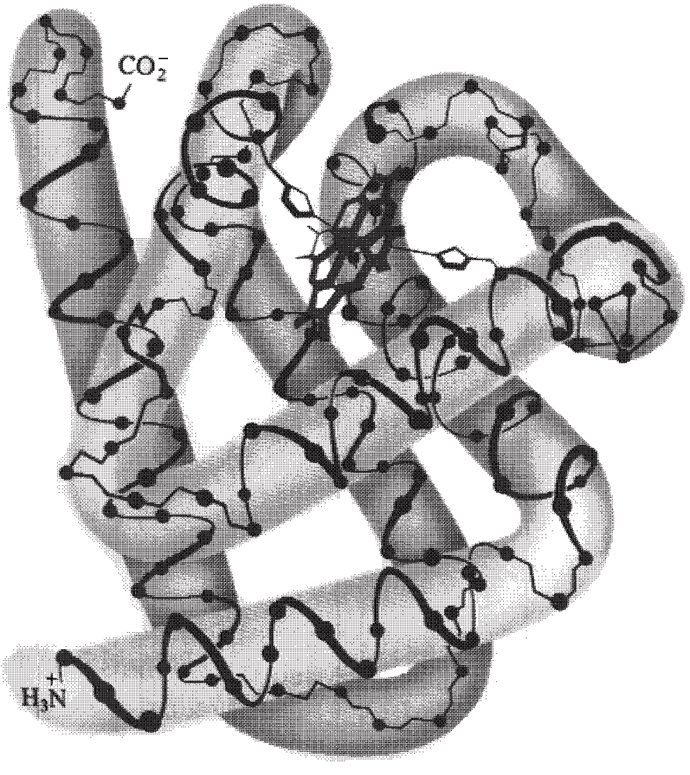 Četras svarīgākās strukturālas iezīmes mioglobīnā ir:
Četras svarīgākās strukturālas iezīmes mioglobīnā ir: