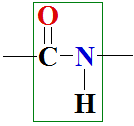
9.1 Peptīdu saite – pirmējā struktūra
Šūnās olbaltumvielas sintezējas ribosomās. Ribosomas ir biokatalizatori - enzīmu sakopojumu kompleksi - aminoskābju bioloģiskās šujmašīnas, kuras polikondensācijas reakcijā ar gēnos iekodētā pareizā secībā vienā virknē ar peptīdu saitēm savieno ikkatru sekundi četrpadsmit iekodētās no 20 dažādām aminoskābēm, veidojot dipeptīdus, tripeptīdus un polipeptīdus.
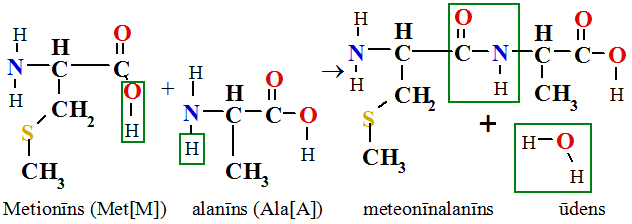
Visas 26000 iekodētās olbaltumvielas sintezējas ribosomās un pirmo aminoskābi no signāl RNS molekulas nolasa metionīnu (Met[M]), ar kuru sākas polikondensācijas reakcijas polipeptīda virknes sintezē pēc signāl RNS molekulā iekodētās aminoskābju secības. Piemēram, pievienojot pirmai aminoskābei alanīnu producējas dipeptīds meteonīnalanīns vai trīs burtu saīsinājumā Met-Ala vai viena burta simbolos MA dipeptīds un ūdens:
Polikondensācijas reakcijā rodas ūdens molekula, tāpēc pretējā reakcija ir hidrolīze. Hidrolīzes reakcija ir reakcija ar ūdeni.
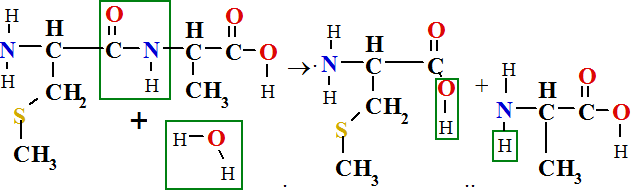
kurā polipeptīdu-olbaltumvielu hidrolīzes produkti ir brīvu aminoskābju šķīdums ūdenī. Tāpēc vārot gaļu zupā hidrolizējas brīvu aminoskābju šķīdums ūdenī, ko sauc par buljonu.
Tripeptīds alanīnserīncisteīns veidojas polikondensējoties trim aminoskābēm alanīns, serīns un cisteīns:

Trīs burtu Ala-Ser-Cys un vien burtu simbolu saīsinājums ir ASC. Aminoskābe numur viens alanīns tripeptīdu virknē ir ar brīvu aminogrupu
H2N- un to sauc par N terminālu. C termināls ir pēdējā aminoskābe cisteīns numur trīs ar brīvu karboksil grupu -
COOH.
9.2 Olbaltumvielu otrējā, trešējā, ceturtējā struktūra un pieci starp molekulārie spēki
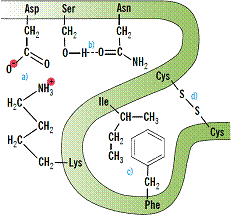
Pieci starp molekulārie spēki nostiprina olbaltumvielu salocīšanos trīs dažādos struktūru veidos, kuras sauc par otrējo struktūru, trešējo struktūru un ceturtējo struktūru. Iepriekšējā nodaļā apskatījām olbaltumvielu pirmējo struktūru, kuru veido polipeptīdu virknes. Pieci starp molekulārie spēki ir:
1. un b) Ūdeņraža saites,
2. un a) Sāls tiltiņi,
3. un d) Disulfīdsaites,
4. un c) Hidrofobās saites un
5. un e) Koordinatīvās saites.
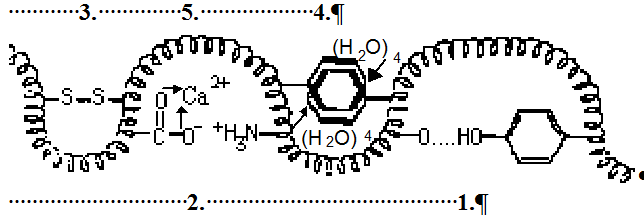
Att.18 stilizēts zīmējums disulfīdsaite Cys S
S S
S Cys, koordinatīvā donoru akceptoru saite kalcija jons ar karboksil grupām
Cys, koordinatīvā donoru akceptoru saite kalcija jons ar karboksil grupām  COO→Ca2+←OOC
COO→Ca2+←OOC vai dzelzs(II) jons hēma centrā →Fe2+←, sāls tiltiņš
vai dzelzs(II) jons hēma centrā →Fe2+←, sāls tiltiņš
Asp COO----H3+N
COO----H3+N Lys, hidrofobā saite (H2O)4→00← (H2O)4 ūdens saspiež nepolāro 0 0 aminoskābju atlikumus, ūdeņraža saite Asn=O...H
Lys, hidrofobā saite (H2O)4→00← (H2O)4 ūdens saspiež nepolāro 0 0 aminoskābju atlikumus, ūdeņraža saite Asn=O...H O
O Ser.
Ser.
1. Ūdeņraža saite veidojas ja starp elektro negatīvajiem ķīmiskajiem elementiem skābekļa atomiem =O...H O
O vai slāpekļa atomiem =N...H
vai slāpekļa atomiem =N...H N= nostājas ūdeņraža atoms, kurš kovalenti saistīts ar vienu no atomiem.
N= nostājas ūdeņraža atoms, kurš kovalenti saistīts ar vienu no atomiem.
Ūdeņraža atoma akceptori skābekļa vai slāpekļa atomi
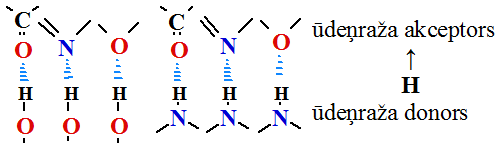
Ūdeņraža atoma donori skābekļa vai slāpekļa atomi.
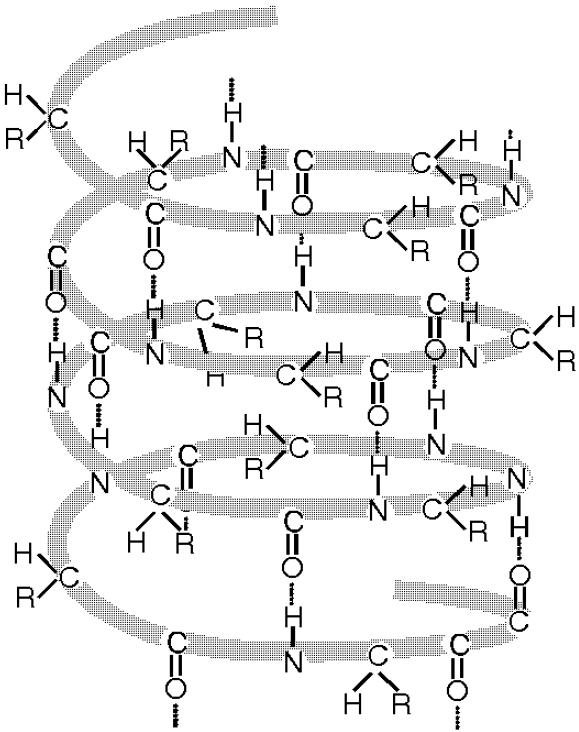
Otrējā struktūra 2°
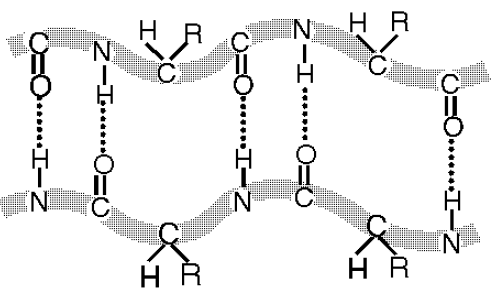
Ūdeņraža saite nostiprina otrējās olbaltumvielu struktūras alfa spirāles, beta plāksnītes un beta cilpas.
 b
b
19 Att. Olbaltumvielu polipeptīdu virknes otrējās struktūras salokas kopā ar ūdeņraža saitēm alfa spirālē (a) un
beta plāksnītē (b) .
19
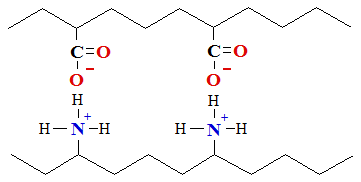
2. Sāls tiltiņi izveidojas starp negatīvi lādētām karbonskābes un pozitīvi lādētām amonija funkcionālām grupām
 COO----H3+N
COO----H3+N
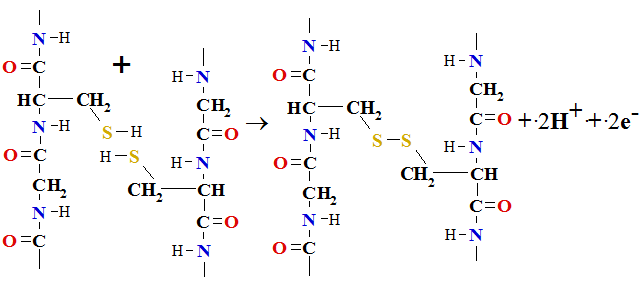
3. Disulfīdsaite izveidojas starp divām olbaltumvielu virknēm maigos oksidēšanas apstākļos saistoties pretī stāvošām cisteīna (Cys[C]) aminoskābēm oksidējot sulfhidril grupas
Cys SH +HS
SH +HS Cys => Cys
Cys => Cys S
S S
S Cys +2H+ + 2e-
Cys +2H+ + 2e-
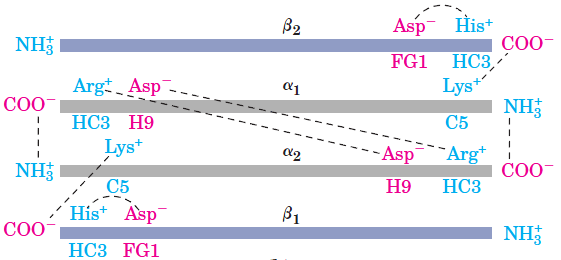
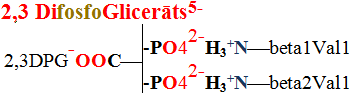
21 Att. Venozo asiņu hemoglobīnā ir desmit sāls tiltiņi, kuri savieno četras alfa1, alfa2, beta1 un beta2 olbaltumu virknes ar pretēji lādētām negatīvām karbonskābes  COO- un pozitīvi lādētām slāpekļa atomu saturošajām
COO- un pozitīvi lādētām slāpekļa atomu saturošajām
H3+N funkcionālām grupām.
funkcionālām grupām.
4. Hidrofobā saite izveidojas ūdens vidē. Satiekoties divām olbaltumvielas virknēm un saskaroties nepolārām aminoskābēm, piemēram, fenilalanīnam un leicīnam vai izoleicīnam, ūdens molekulas saspiež kopā ar spēku, kurš ir desmit reizes stiprāks par Van der Walsa spēkiem. Hidrofobo spēku ietekmē uzsildīts želatīna ūdens šķīdums atdziestot, kurš veido želeju, līdzīgi kā izvārīta cūku kājiņu vai galvas zupa atdziestot pārvēršas galertā vai par zilcu, jo hidrofobo spēku iespaidā ūdens saspiež nepolārās aminoskābes, kuras atrodas blakus kaimiņos savstarpējā kontaktā esošās olbaltumvielu (polipeptīdu) virknēs.
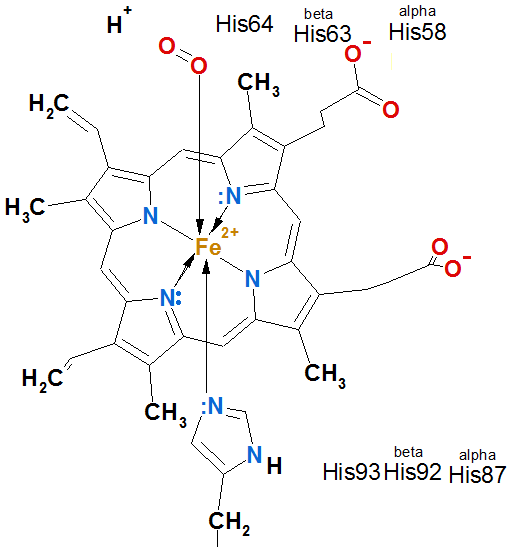
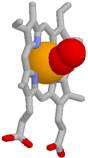
5. Koordinatīvo saiti veido kompleksu veidotāji (sk. A.Rauhvargers Vispārīgā Ķīmija Kompleksie savienojumi200.lpp) tie ir metālu joni: dzelzs(II) joni Fe2+, dzelzs(III) joni Fe3+, kalcija joni Ca2+, magnija joni Mg2+ arī cinka joni Zn2+ vai vara joni Cu2+ un citi, kuri ir donoru atomu skābekļa un slāpekļa brīvo nedalīto elektronu pāru akceptori, un, kuri ar koordinācijas skaitli 6 (Fe2+,Fe3+, Ca2+, Mg2+) vai 4 (Zn2+, Cu2+) koordinē ap metāla jonu 6 vai 4 aplocītās olbaltumvielas skābekļa un slāpekļa atomus, stabilizējot olbaltumvielas trešējo un ceturtējo struktūru.
20
Trešējā struktūra 3°
Trešējā struktūrā salokās otrējās struktūras elementi:
alfa spirāles, kuras līdzinās olbaltuma virknes aptītai caurulei, kā arī beta plāksnītes un beta cilpas, kuras nodrošina beta plāksnītēs olbaltuma virkņu paralēlo novietojumu cieši saistoties ar ūdeņraža saitēm. Trešējās struktūras veidošanā piedalās starp molekulārie mijiedarbības spēki un dažkārt visi pieci:
1. Ūdeņraža saites, 2. Sāls tiltiņi, 3. Disulfīdsaites,
4. Hidrofobās saites un 5.Koordinatīvās saites.
Ceturtējā struktūra 4°
Ceturtējā struktūra ir vairāku olbaltumvielu atsevišķu virkņu sakopojums, kuras kopā saista pieci starp molekulārie spēki 1.Ūdeņraža saites, 2. Sāls tiltiņi, 3. Disulfīdsaites,
4. Hidrofobās saites un 5. Koordinatīvās saites. Piemēram:
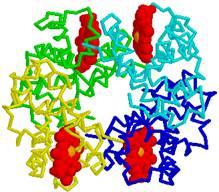
Hemoglobīna molekulā četras olbaltumu virknes trešējā struktūrā alfa1, alfa2, beta1 un beta2 saista 1. Ūdeņraža saites,
2. Sāls tiltiņi, 4. Hidrofobās saites un 5.Koordinatīvās saites Fe2+
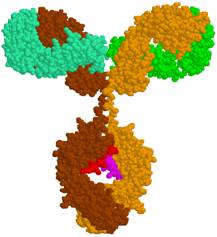
Imunoglobulīna molekulā divas smagās un divas vieglās olbaltumu virknes trešējā struktūrā saista 1.Ūdeņraža saites,
2. Sāls tiltiņi, 3. Disulfīdsaites un 4. Hidrofobās saites.
Olbaltumvielu denaturācija
Olbaltumvielas ceturtējās, trešējās un otrējās struktūras izjaukšanu sauc par denaturāciju. Piemēram, olas baltums ir caurspīdīgs plūstošs viskozs šķidrums , kura dabisko izskatu nosaka ietilpstošo olbaltumvielu pirmējā, otrējā, trešējā un ceturtējā struktūra. Vārītas olas baltums ir balta sarecējusi masa, jo paaugstinātā temperatūrā vārot pārtrūkst četri starp molekulārie spēki: 1. Ūdeņraža saites, 2. Sāls tiltiņi, 4. Hidrofobās saites un 5.Koordinatīvās saites.
3. Disulfīdsaites noārdās vienīgi reducētāju iedarbībā un biezpienā esošās disulfīda saites nevar saraut tikai karsējot. Tāpēc karsējot biezpienu var iegūt nākamo pārstrādes produktu – sieru.
Gatavojot ēdienu cilvēki ir iemācījušies denaturēt olbaltumvielas uzturā, lai pilnvērtīgāk izmantotu uzturā esošās aminoskābes, jo organismā uzsūcas tikai brīvas aminoskābes. Tāpēc cilvēki gatavojot ēdienu pielieto tādas pašas metodes kā ķīmijas laboratorijas metodes: sadalīšanu vai saberšanu sīkākos gabalos, sildīšanu un vārīšanu, skābju pievienošana, piemēram, etiķskābe, citronskābe vai vīna pievienošana, kurā vienmēr atrodas skābes.
Minētās denaturācijas darbības ar uzturā lietojamām olbaltumvielām izjauc olbaltumvielu ceturtējo, trešējo un otrējo struktūru, bet hidrolīzes reakcijas izjauc pirmējo struktūru un atbrīvo aminoskābes, kuras uzsūcas cilvēka organismā no uzturam pagatavotā ēdiena, lai šūnu iekšpusē ribosomās sintezētos jaunas organismam nepieciešamas olbaltumvielas.
21





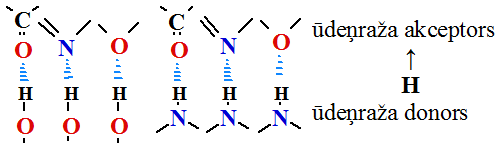
 b
b